
Homeopatyczne produkty Hyland’s dla ząbkujących maluchów wycofywane ze sprzedaży
Kilka dni temu firma Standard Homeopathic Company zarządziła wycofanie ze sprzedaży kilku produktów marki Hyland’s ze względu na nieprawidłowe oznakowanie.
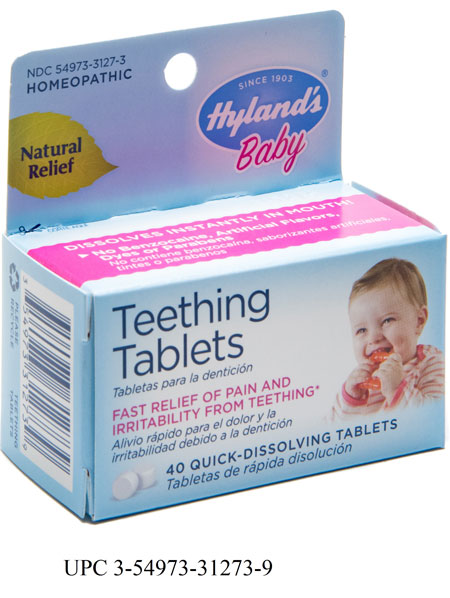
Wycofaniu podlegają wszystkie produkty Hyland’s Baby Teething Tablets i Hyland’s Baby Nighttime Teething Tablets, dostępne w wielu punktach sprzedaży produktów dla dzieci w całym kraju.
FDA doszło do wniosku, że produkty zawierały niejednolite ilości alkaloidów belladonny, które mogą się różnić od ilości podanej na etykiecie produktu.
Belladonna (w języku polskim znana także jako pokrzyk wilcza jagoda) jest rośliną od wieków wykorzystywaną ze względu na właściwości lecznicze, ale jest także rośliną trującą. FDA poinformowało Standard Homeopathic Company, że zbyt wiele czynników ma wpływ na produkty Hyland’s, w związku z czym nie udało się ustalić bezpiecznej dawki alkaloidów belladonny, co zdecydowało o tym, że FDA określiła produkty Hyland’s jako nie spełniające wymogów bezpieczeństwa i mogące stanowić poważne zagrożenie dla zdrowia dzieci.
Rozpuszczalne homeopatyczne tabletki Hyland’s Baby Teething Tablets i Hyland’s Baby Nighttime Teething Tablets były używane w celu przyniesienia tymczasowej ulgi dzieciom w okresie ząbkowania.
Firma przestała, na żądanie FDA, produkować i rozsyłać do punktów sprzedaży produkty Hyland’s Teething Tablets w październiku 2016. Wycofanie dotyczy wszystkich tych produktów, które sprzedawcy mogą jeszcze mieć w magazynach czy na półkach sklepowych.
Inne produkty Standard Homeopathic Company/Hyland’s nie są objęte tym wycofaniem.
CEO Standard Homeopathic Company J.P. Borneman, PhD, oświadczył, że wycofanie i zaprzestanie produkcji jest wyłącznie rezultatem podporządkowania się oficjalnemu zarządzeniu FDA i że ma nadzieję, iż 144 letnia historia i działalność firmy pozwolą jej na zachowanie dobrych relacji i zaufania konsumentów.
SHC już powiadomiło sprzedawców i dystrybutorów o wycofaniu. Konsumenci, którzy już zakupili których z produktów na liście proszeni są o zaprzestanie używania. Osoby, które mają dodatkowe pytania dotyczące tego wycofania mogą się kontaktować z SHC pod numerem telefonu 1-800-991-3376 od poniedziałku do piątku w godzinach 6 am-4 pm czasu Pacific.
Osoby, które podejrzewają, że produkt mógł spowodować niepożądaną reakcje powinny się skontaktować ze swoim lekarzem. Niepożądane reakcje można także zgłaszać osobiście w formie elektronicznej na stronie www.fda.gov/medwatch/report.htm.











0 Comments
No comments!
There are no comments yet, but you can be first to comment this article.